1.造血幹細胞移植の概要
造血幹細胞移植では、まず移植前処置が行われます。移植前処置は、大量化学療法(通常の数倍以上の細胞障害性抗がん薬を使う治療)や全身放射線治療(全身に放射線を照射する治療)、これらの治療などを組み合わせて行われます。
移植前処置のあと、患者本人またはドナーから事前に採取した造血幹細胞を輸注(静脈から点滴のように投与すること)します。
なお、移植する造血幹細胞の種類によって、自家造血幹細胞移植(自家移植)と同種造血幹細胞移植(同種移植)があります。どちらの方法で行われるかは、移植の目的や疾患の種類によって異なりますので、担当の医師にご確認ください。それぞれの移植の詳しい方法は、関連情報をご確認ください。
2.造血幹細胞とは
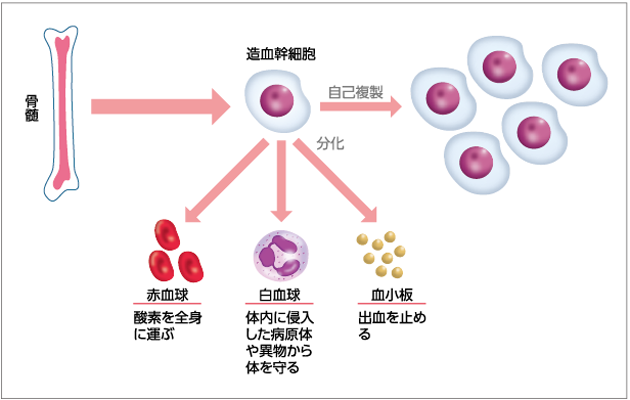
造血幹細胞とは、赤血球・白血球・血小板のもとになる細胞のことです。造血幹細胞が骨の中心部にある骨髄という組織の中で盛んに細胞分裂をして、赤血球・白血球・血小板がつくられます。
造血幹細胞は、赤血球・白血球・血小板に成長する性質と、細胞分裂によって自らと同じ細胞を増やして数を維持する性質とを兼ね備えています。造血幹細胞が赤血球・白血球・血小板に成長する過程を「分化」、細胞分裂によって自らと同じ細胞を増やす能力を「自己複製」といいます(図1)。
3.自家造血幹細胞移植(自家移植)
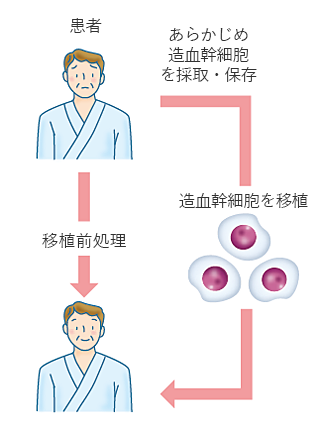
患者本人の造血幹細胞を用いる移植方法です。あらかじめ採取・凍結保存しておいた造血幹細胞を大量化学療法による移植前処置のあとに解凍し、輸注します。(図2)。移植前処置による抗腫瘍効果(腫瘍細胞を減少させる効果)が治療の主な目的です。
自分の造血幹細胞を移植するため、免疫抑制剤が不要で免疫回復が速やかなどの長所がありますが、造血幹細胞を採取するときに腫瘍細胞が混入する場合があることなどから、再発のリスクが高まることがあります。
なお近年はほとんどの場合、移植する造血幹細胞は、骨髄ではなく末梢血幹細胞です。通常、造血幹細胞は骨髄にあり、血液中には流れていませんが、白血球を増やす薬(G-CSF:顆粒球コロニー刺激因子)を使ったときなどの特殊な状況では、骨髄から血液中に流れ出すことがあり、これを末梢血幹細胞といいます。G-CSFの投与を受けたあと、血液中に流れ出した造血幹細胞(末梢血幹細胞)を採取します。
4.同種造血幹細胞移植(同種移植)
「同種」とは「同じ種類の生物」という意味です。同種移植とはヒト(ドナー)の造血幹細胞をヒト(患者)に移植することです。
1)同種造血幹細胞移植(同種移植)の概要
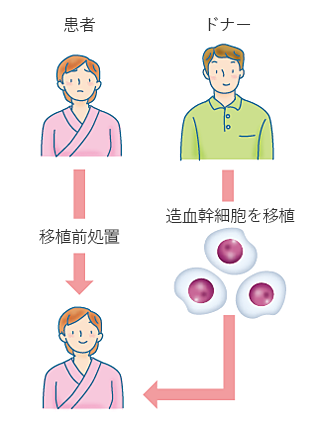
大量化学療法や全身放射線治療といった移植前処置のあとに、ドナーから提供された造血幹細胞を輸注します(図3)。
移植前処置によって腫瘍細胞を減少させる抗腫瘍効果と、移植後にドナーのリンパ球が患者の腫瘍細胞を攻撃することによって再発を抑える移植片対白血病効果あるいは移植片対リンパ腫効果(GVL効果:Graft Versus Leukemia/Lymphoma効果)の2つの力により、治すことが難しい種類の血液・リンパのがんの完治を目指します。
ドナーの造血幹細胞を移植するため腫瘍細胞は混入しませんが、患者の免疫細胞がドナーの血液細胞を異物と認識して攻撃する拒絶反応や、ドナーのリンパ球が患者の臓器を異物とみなして攻撃することによって起こる移植片対宿主病(Graft Versus Host Disease:GVHD)のリスクがあり、免疫抑制剤による治療が必要です。また免疫の回復に時間がかかるため、感染症にかかりやすくなります。
なお同種移植では、ドナーと患者との間で、白血球の型であるHLA(Human Leukocyte Antigen:ヒト白血球抗原)の一致度がより高いほうが移植の条件がよいとされています。HLAの詳しい情報は、関連情報をご覧ください。
2)移植前処置の強度(骨髄への影響の強さ)
移植前処置は骨髄への影響の強さによって、骨髄破壊的処置(フル移植)と骨髄非破壊的処置(ミニ移植)に大きく分けられます。
(1)骨髄破壊的処置(フル移植)
大量化学療法や全身放射線治療など、骨髄への影響が非常に強力な骨髄破壊的処置のあとに、ドナーの造血幹細胞を輸注します。
移植前処置が非常に強力で、抗腫瘍効果(腫瘍細胞を減少させる効果)が高い一方で合併症が起きやすいため、通常、50歳以下あるいは55歳以下で、なおかつ体の状態(全身状態)が良好な場合にのみ適応となります(表1)。
(2)骨髄非破壊的処置(ミニ移植)
骨髄破壊的処置(フル移植)よりも薬物療法の用量や放射線治療の線量を少なくするなどして、骨髄への影響を弱めた骨髄非破壊的処置(ミニ移植)を行ったあと、ドナーの造血幹細胞を輸注します。ミニ移植は、フル移植と比べて移植前処置による合併症が少ないため、高齢者や臓器に障害がある人も適応となることがあります。
フル移植に比べて、抗腫瘍効果(腫瘍細胞を減少させる効果)や免疫抑制効果(患者本人の免疫細胞を抑制すること)が弱いため、もとのがんの再発や拒絶反応(患者の免疫細胞がドナーの血液細胞を異物と認識して攻撃すること)が増加するリスクがあります(表1)。
| 長所 | 短所 | |
|---|---|---|
| 骨髄破壊的移植 (フル移植) |
・抗腫瘍効果が高い | ・合併症リスクが高く、 年齢や全身状態などの制限がある |
| 骨髄非破壊的移植 (ミニ移植) |
・合併症リスクが低く、 高齢者や臓器障害がある人でも 行える場合がある |
・抗腫瘍効果や免疫抑制効果が弱いため、 再発や拒絶反応が増加する可能性がある |
3)造血幹細胞の種類(骨髄、末梢血幹細胞、臍帯血)
造血幹細胞は、通常は骨髄にあります。しかし、白血球を増やす薬(G-CSF:顆粒球コロニー刺激因子)を使ったときなどの特殊な状況では、骨髄から血液中に流れ出すことがあり、これを末梢血幹細胞といいます。また、臍帯血(臍帯と胎盤に含まれる胎児の血液)にも豊富に造血幹細胞が含まれています。同種移植では、骨髄、末梢血、臍帯血のいずれかに含まれる造血幹細胞を採取し移植します。
(1)骨髄
骨髄移植は、骨髄液を採取して造血幹細胞を移植する方法です。通常、骨髄液は腸骨という骨盤の骨から、全身麻酔をして採取します(図4)。
自己血貯血(骨髄採取の前に血液を採取して保存しておくこと)や採取の際に全身麻酔が必要であること、採取後に痛みがあることなどドナーの負担が大きいですが、1回の採取で移植に必要な造血幹細胞を確保することができます。
末梢血幹細胞移植に比べてGVHDのリスクが低く、好中球の回復(生着)に3週間前後かかるとされています(表2)。
(2)末梢血幹細胞
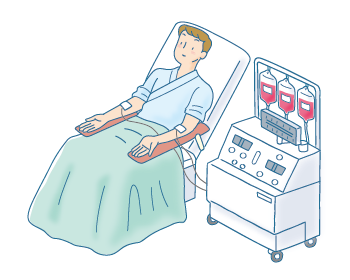
末梢血幹細胞移植は、ドナーの血液中の造血幹細胞を採取して移植する方法です。通常、造血幹細胞は骨髄にあり、血液中には流れていません。そのため、ドナーにG-CSFという薬を投与して人工的に白血球を増やしたあと、血液中に流れ出した造血幹細胞(末梢血幹細胞)を「血液成分分離装置」を使って採取します(図5)。
自己血貯血や全身麻酔は不要ですが、G-CSFの投与が必要で、1回の採取で必要な造血幹細胞の数を確保できないことがあります。
慢性GVHDが起こることが多く、生着までの期間は2週間前後とされています(表2)。
(3)臍帯血
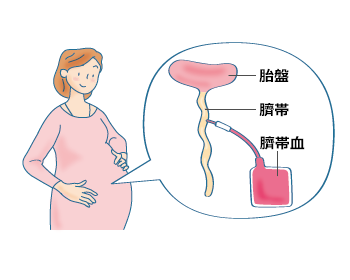
臍帯血移植は、臍帯血の提供に同意した妊産婦の臍帯および胎盤から出産後に臍帯血を採取し、採取した臍帯血中に含まれる造血幹細胞を移植する方法です(図6)。ドナーへの負担がなく、凍結保存されているため1~2週間で入手できますが、採取できる造血幹細胞の数は少なくなります。
慢性GVHDが起こりにくく、生着までの期間は3~4週間とされています。また、生着不全(移植から一定期間を過ぎても白血球が増えてこないこと、あるいは一度増えた白血球が再び減少してしまうこと)やウイルス感染症のリスクが高いとされています(表2)。
| 長所 | 短所 | |
|---|---|---|
| 骨髄 |
|
|
| 末梢血幹細胞 |
|
|
| 臍帯血 |
|
|
5.HLA(Human Leukocyte Antigen:ヒト白血球抗原)とは
HLAとは、ヒトがもつ白血球の型です。多くの型がありますが、造血幹細胞移植では、HLAの中でも特に、HLA-A・HLA-B・HLA-C・HLA-DRの4種類が重要です。
HLA-A・HLA-B・HLA-C・HLA-DRは、組み合わせが異なるHLAが2セット、合計8抗原からなります。患者とドナーの間でこれらの抗原を合わせる必要があり、すべてが一致することが最良です。
HLAは両親から1セットずつ遺伝的に受け継ぐため、きょうだい間でHLA-A・HLA-B・HLA-C・HLA-DRの8抗原が完全に一致する確率は1/4です。しかし、HLA-A・HLA-B・HLA-C・HLA-DRそれぞれも数十の種類があるため、非血縁者間で8抗原がすべて一致する確率は極めて低くなります。
そのため、ドナー候補は、まずHLAが一致する確率が高い血縁者(きょうだい、親子など)から探します。血縁者にHLAの8抗原が一致する人が見つからないときは、骨髄バンクに登録し、非血縁ドナーを探します。
なお、HLA-A・HLA-B・HLA-C・HLA-DR の8抗原すべてが一致しないと造血幹細胞移植ができないわけではありません。近年では、免疫抑制療法(免疫抑制剤を使って、免疫反応を抑えるための治療)の工夫により、親子などでHLAが1セットしか合っていないドナーからの移植(HLA半合致移植、通称ハプロ移植)も一般的になっています。また、臍帯血移植は、HLA-A、HLA-B、HLA-DRの6抗原のうち、2抗原が不一致でも実施可能とされています。
骨髄バンクドナーの準備(コーディネート)には数カ月かかるため、移植を急ぐ場合には、準備期間の短い臍帯血やHLAの一致度が低い血縁者ドナーからの造血幹細胞移植を優先して行うこともあります。
しかし、HLAの一部が不一致のドナーから移植を受けた場合は、生着不全(移植から一定期間を過ぎても白血球が増えてこないこと、あるいは一度増えた白血球が再び減少してしまうこと)や移植片対宿主病(GVHD)などの免疫が関連する合併症のリスクが高くなります。そのため、免疫抑制療法により合併症を予防します。
6.参考文献
- 日本造血・免疫細胞療法学会ウェブサイト.造血幹細胞移植ガイドライン 移植前処置(第2版);2020年(閲覧日2023年12月8日)https://www.jstct.or.jp/
- 日本造血・免疫細胞療法学会ウェブサイト.造血幹細胞移植ガイドライン HLA不適合血縁者間移植(第2版);2018年(閲覧日2023年12月8日)https://www.jstct.or.jp/
- 日本造血・免疫細胞療法学会ウェブサイト.造血幹細胞移植ガイドライン 臍帯血移植;2022年(閲覧日2023年12月8日)https://www.jstct.or.jp/
- 日本造血・免疫細胞療法学会ウェブサイト.造血幹細胞移植ガイドライン 造血幹細胞採取(第2版);2022年(閲覧日2023年12月8日)https://www.jstct.or.jp/
作成協力
