ここでは、「研究段階の医療」を評価するための「臨床試験」の基本的な仕組みから、臨床試験に関するさまざまな制度について紹介します。
1.研究段階の医療の基本~臨床試験の仕組み
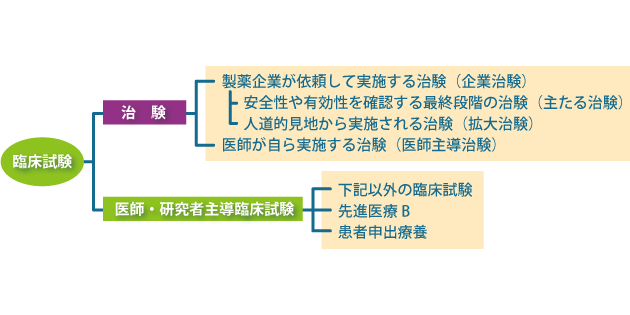
治験以外の臨床試験は、医師・研究者が主体となって行う「医師・研究者主導臨床試験」で行われます。これまで厚生労働省で承認された薬、治療法や診断法を用い、最良の治療法や診断法、薬のよりよい組み合わせを確立することを目的とする試験などがこれに含まれます。
これらの治験や医師・研究者主導臨床試験は、よりよい標準治療のための研究を目的としていますが、さらに、臨床試験等を実施するためのさまざまな制度が設けられています。例えば、医療上の必要性は高いが企業ではなかなか開発が進められない場合などに、「医師主導治験」として医師自らが治験を実施できるようになりました。また、保険診療とすべきかどうかの評価が必要であると定められた「先進医療B」は未承認薬等を保険診療とともに用いることができる「評価療養」として位置付けられています。そして、患者さんからのアクセスを広げるための制度として設けられた、「人道的見地から実施される治験(以下、拡大治験)」や「患者申出療養」があります。
各制度については、次の項の「2.研究段階の医療に対する制度について~保険外併用療養費制度」をご覧ください。
また、臨床試験の進み具合には大きく3つの段階があり、各段階で安全性や有効性を確認しながら順番に進めていきます。この開発の3つの段階のことを、第Ⅰ相、第Ⅱ相、第Ⅲ相(あるいは、フェーズ1、フェーズ2、フェーズ3)などと呼びます。第Ⅰ相よりも第Ⅱ相、第Ⅱ相よりも第Ⅲ相のほうが治療法の開発が進んだ段階にあり、より臨床現場に近い状況にあります。
ここでは、がんの一般的な治療法の開発の進め方について説明します。ただし、薬や治療法によって進め方に違いが生じることがあります。
がん種を問わず、少数の患者さんが参加します。
段階的に投与量を増やしていき、薬の安全性の確認、有効で安全な投与方法などを調べます。
がん種や病態を特定し、第Ⅰ相(フェーズ1)よりも多い数の患者さんが参加します。
前の段階で有効で安全と判断した投与方法を用い、薬の安全性と有効性を確認します。
より多くの患者さんが参加します。
新しい薬や治療法が従来の薬や治療法(標準治療)と比べ、安全性や有効性の面で優れているかどうかをランダム化比較試験で確認します。ランダム化比較試験では治療効果を客観的に評価するために、新しい薬や治療法で試験をするグループと、従来の薬や治療法(標準治療)で試験をするグループとで、患者さんを無作為(ランダム)に分けて試験を行います。そのため、患者さんが新しい薬や治療法を希望したとしても、実際に試験を受けられるかどうかはわかりません。
2.研究段階の医療に関する制度について~保険外併用療養費制度
わが国においては、国民皆保険の理念の下、必要かつ適切な医療は基本的に保険診療として認められています。一方で、保険診療と保険外診療の併用(いわゆる混合診療)は原則として禁止されています。それは、混合診療を制限なく許してしまうと、本来なら保険診療でよいところを保険外診療で行うことや、安全性や有効性がまったく確認されていない医療を保険外診療として行うことを助長するおそれがあるからです。
しかし、研究段階の医療では、保険診療として認められていないものの、将来的に保険診療となることを目指すものであることから、安全性や有効性を確認するなどの一定のルールの下で保険診療との併用ができるよう、保険外併用療養費制度として、いくつかの公的な制度が設けられています(表1)。
その1つが評価療養で、保険診療とすべきかどうかの評価が必要であると厚生労働大臣が定めた治療法として、保険診療との併用が認められています。評価療養には、医薬品・医療機器等としての承認を得るための評価がされる「治験」や、厚生労働大臣が定めた「先進医療」も含まれます。
また、保険外併用療養費制度の対象となるものには、患者さんが研究段階の医療にアクセスできる方法を広げる制度もあります。1つは「拡大治験」で、医薬品・医療機器等のうち開発がかなり進んだ段階にあるものについて、現在治験の対象となっていない患者さんに特別に治験として実施するものです。これは通常の治験と同じ評価療養です。もう1つは、「患者申出療養」で、さまざまな治療法を対象とすることにより、患者さんからのアクセスを広げる方法です。こちらは評価療養ではありませんが、保険診療とすべきかどうかの評価が必要とされる療養として保険診療との併用が認められています。
| 評価療養 | 企業治験 主たる治験 拡大治験 医師主導治験 先進医療 |
保険収載を前提に評価を行うもの |
|---|---|---|
| 患者申出療養 | 患者申出療養 | |
| 選定療養 | 特別の療養環境(差額ベッド)など※ | 保険収載を前提としないもの |
3.研究段階の医療にかかる費用負担
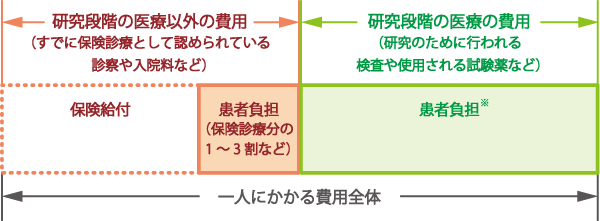
研究段階の医療にかかる費用は、保険外併用療養費制度に基づきます。一人にかかる費用全体を、通常は図2のように、「研究段階の医療の費用」と「研究段階の医療以外の費用」とに分けて考えます。「研究段階の医療の費用」は、研究のために行われる検査や使用される薬剤などにかかる費用のことで全額患者の自己負担とされています。「研究段階の医療以外の費用」は、すでに保険診療として認められている診察や入院料などにかかる費用のことで、各健康保険制度における一部負担金のみとなります。
一方で、保険診療との併用が認められていない自由診療の場合には、一般的な保険診療にかかる費用も全額自己負担となります。
| 種類 | 研究段階の医療の費用 (研究のために行われる検査や試験期間中に使用される試験薬など) |
|---|---|
| (1)企業治験 | 患者負担なし※ |
| (2)主たる治験 | 患者負担なし※ |
| (3)拡大治験 | 患者負担あり |
| (4)医師主導治験 | 試験により患者負担あり |
| (5)先進医療A | 患者負担あり |
| (6)先進医療B | 試験により患者負担あり |
| (7)医師・研究者主導臨床試験 (先進医療Bおよび患者申出療養を除く) |
試験により患者負担あり |
| (8)患者申出療養 | 患者負担あり |
「研究段階の医療の費用」と「研究段階の医療以外の費用」をそれぞれだれが負担するべきかについてはさまざまな考え方があり、研究開発に携わる側が両者をすべて負担するという考え方もあれば、患者が両者をすべて負担するという考え方(いわゆる自費診療による研究段階の医療の実施)もあります。
中でも、研究段階の医療を評価して、承認されていない薬・医療機器の開発・承認を進める目的のある企業治験では、「研究段階の医療の費用」を企業が負担します。それ以外については企業の開発とは別に発生するものであり、治験薬にかかる費用などでは、患者負担を求められることがあります。
4.専門用語解説
| 標準治療 | 臨床試験により、安全性や有効性が確認された現時点で最良の治療。 |
| 研究段階の医療 | よりよい標準治療の確立を目指している研究・開発中の医療。 |
| 臨床研究 | 人を対象に行われるすべての研究。 |
| 臨床試験 | 薬の投与、手術、放射線治療などにより、人体に対して変化を伴う介入研究。 |
| 介入研究 | 対象者に対して何らかの変化を起こさせ、その結果どのように変化したかを評価する研究。対象者を患者とした研究を臨床試験といいます。 |
| 治験 | 医薬品医療機器等法に従い、未承認薬や適応外薬、新しい医療機器等に対して、厚生労働省から医薬品・医療機器等としての承認を得ることを目的として行う臨床試験。 |
| 医薬品医療機器等法 | 「医薬品、医療機器等の品質、有効性および安全性の確保等に関する法律」の略称。医薬品・医療機器等の有効性・安全性を確保するために定められた、製造から販売、市販後の安全対策まで一貫した規制にかかわる法律。 |
| 未承認薬 | 厚生労働省から承認されていない薬。 |
| 適応外薬 | 厚生労働省からその疾患に対して使用が承認されていない薬。 |
| 保険診療 | 必要かつ適切な医療について認められている、健康保険で受けられる診療。 |
| 保険収載 | 保険診療として認められること。 |
| 混合診療 | 保険診療と保険外診療を併用する診療。 |
| 保険外併用療養費制度 | 例外的に未承認薬等の使用と保険診療との併用を認める制度。 |
| 未承認薬等 | 未承認薬、未承認機器、未承認再生医療等製品のことを指します。 |
| 評価療養 | 厚生労働大臣が保険診療とすべきかどうかの評価が必要であると定めた治療法で、保険外併用療養費制度の中で保険診療との併用が認められている療養。 |
| 先進医療 | 厚生労働大臣が保険診療とすべきかどうかの評価が必要であると定めた評価療養の1つ。 |
