1.研究段階の医療と標準治療
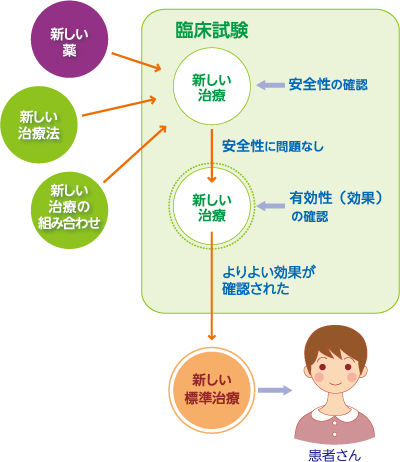
「研究段階の医療」は新しい治療法の効果や安全性を確認(証明)するために、実際に人を対象として行う「試験」のことで、よりよい「標準治療」の確立を目指して実施されています。標準治療は、科学的根拠に基づいた最良の医療として推奨される治療法であり、保険診療で受けることができます。現在行われている標準治療は、より多くの患者がより優れた治療を受けられるように、研究段階の医療を積み重ねてつくられてきたものです。よりよい標準治療の確立を目指して、「臨床試験」などの研究段階の医療が行われています(図1)。
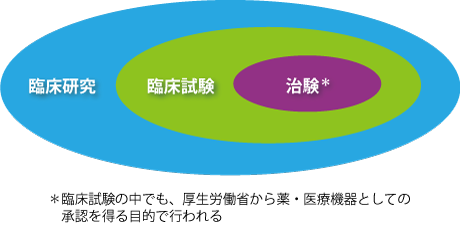
臨床試験は臨床研究の枠組みの中で行われます。「臨床研究」は人を対象に行われるすべての研究を指しますが、その中でも、新しい治療法や診断法、予防法などの有効性や安全性を調べる研究が臨床試験です。また、臨床試験の中でも特に、厚生労働省から薬・医療機器としての承認を得ることを目的として行う試験を「治験」といいます(図2)。
2.研究段階の医療を受けるには
研究段階の医療は、よりよい医療を提供することを目的に多くの専門家によって審議され、臨床研究に関わる法律などに基づいて実施されている試験(臨床研究)です。参加条件は試験ごとに異なり、対象者はがん治療の経験がない人、標準治療が終了した人などさまざまです。効果や安全性が証明されていないため、「保険診療(通常の医療)」の対象外になります。
1)研究に参加するためにはさまざまな条件を満たす必要があります
研究段階の医療はまだ承認されていない新しい治療法や薬を対象に、有効性(治療効果)と安全性を調べるために行われています。科学的なデータを収集する必要があるため、実施できる場所は限られ、参加者についてもさまざまな条件があります。研究段階の医療が受けられるかどうかを知りたいときは、まずは病状をよく知る担当医に相談して意見を聞くことが大切です。また、研究段階の医療はすべての医療施設で行われるわけではなく、研究ごとに限られた医療施設で実施されます。場所などの詳細を知りたい場合は「がん相談支援センター」に相談するのもよいでしょう。
研究段階の医療を受けられる人
- 研究の内容や目的に合った人(疾患名、治療歴など)
- 他に目立った病気がなく、体調面に余裕のある人
- まだ承認されていない新しい治療を受けられる可能性がある一方で、効果がない、副作用を引き起こすなどの不利益を被る可能性があることを十分に理解し、納得している人
- 研究を実施する医療施設に通院ができる人
- 研究に参加するための条件(適格基準)を満たし、担当医が参加できると判断した人
参加するための条件を満たしているかどうかについては、血液検査やCT検査など必要な検査を行って確認します。原則として研究を実施している医療施設への通院が必要ですが、最近では、すべてあるいは一部をリモート(オンライン)で行う分散型臨床試験(decentralized clinical trial:DCT)と呼ばれる新たな取り組みも開始され、遠方から参加する人の通院負担を減らす手段として期待されています。
研究段階の医療を受けられる場所
- 該当する研究の実施対象となっている医療施設
研究段階の医療では、研究内容を審査する体制と参加者への緊急時対応ができる体制が求められるため、研究が実施できる医療施設は限られています。また、施設によって、実施している研究内容はさまざまですので、研究ごとに施設の場所も数も違ってきます。
なお、参加を希望する研究が、分散型臨床試験(DCT)の場合は、自宅や近隣のクリニック(委託された検査などを行うパートナー施設)などで、研究段階の医療を受けられることもあります。
2)研究への参加はリスクを伴います
研究段階にある治療法は、思わぬ副作用を引き起こすことがあるかもしれません。あるいは、期待したような効果がみられないこともあります。さらに、人の体は一人一人個性があり、同じ治療を受けても効果がある人とそうでない人がいます。研究段階の新しい治療法によって利益が得られる可能性がある一方で、不利益を被る可能性があることも十分に理解しておく必要があります。
また、研究段階の医療を希望する場合は、専門家からの説明を理解し、十分に納得した上で、参加に同意する必要があります。なお、同意書に署名したあとでも、さらに研究(試験)が始まる直前やすでに試験が始まっている場合でも、いつでも理由を問わずにやめることができます。やめたいと考えたときには、いつでも担当医に申し出てください。
3)保険診療との併用が認められています
研究段階の医療は保険外診療として扱われますが、将来的に保険診療となることを目指し、多くの専門家によって審議され、臨床研究に関わる法律などに基づいて行われることから、公的な制度により「混合診療」(保険診療と保険外診療の併用)が認められています。これにより、保険診療分の自己負担は軽減されます。
一方、専門家による審議や法律などの規制がない「自由診療」と呼ばれる医療が、一部の医療施設で行われていることがあります。自由診療も効果や安全性が証明されていない治療法で保険外診療になりますが、研究段階の医療と違って保険診療との併用は認められていません。治療費が全額自己負担になるのに加えて、診察、入院、検査、副作用に関わる費用なども全額自己負担となりますので受ける場合は注意が必要です。
3.研究段階の医療を支える人たち
研究段階の医療は臨床試験によって評価されます。臨床試験を安全に、倫理的に、かつ科学的に行うために、医師や臨床試験専門のスタッフ(臨床研究コーディネーター:CRC)をはじめ、多くの専門家が関わって研究段階の医療を支えています(図3)。
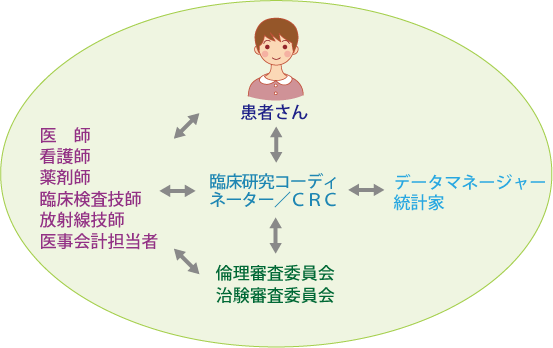
臨床試験の実施に当たってはまず、医師や製薬企業から独立した中立な立場にある倫理審査委員会・治験審査委員会が、新しい治療法を実施することが倫理的かどうか(モラルに反していないか)、科学的に妥当かどうかについて判断します。実際に臨床試験が行われると、データマネージャーは、患者が受けた治療の効果や副作用に関する情報を集めて正確に記録し、管理します。また、統計家はそれらの情報を使って有益な情報が得られるように、データを解析します。さらに、倫理審査委員会・治験審査委員会は、臨床試験が適切に行われているかどうかをチェックします。
4.研究段階の医療とプライバシーの保護
研究段階の医療を評価する臨床試験では、患者の個人情報や診療情報などを収集して利用します。しかし、名前や住所などの個人を特定できる情報を利用することはなく、プライバシーは保護されています。利用する個人情報の項目や利用目的の詳細については、医師の説明や臨床試験の説明文書で確認してください。
なお、臨床試験では、以下のような場合に第三者が個人情報を利用することや、収集された情報が公表されることがあります。ただし、いずれの場合も個人を特定できる情報が第三者に渡されたり、公表されたりすることはありません。
製薬企業や厚生労働省の担当者による監査
製薬企業や厚生労働省の担当者は、臨床試験が規制を守り、かつ事前に作成された試験実施計画書通りに、倫理性や科学性を確保しながら行われているかどうかを確認します。カルテや検査結果などを直接、あるいは間接的に確認しますが、担当者には秘密保持義務が課されています。
新薬としての承認申請のための資料
「治験」の場合は、製薬企業が、収集した患者の情報を新薬承認申請資料として厚生労働省へ提出します。ただし、申請資料には個人を特定できる情報は含まれません。
臨床試験の結果の公表
臨床試験の結果は学会や学術雑誌などで公表され、新しい知見として患者の治療に役立ちます。ただし、個人を特定できる情報は含まれません。
5.研究段階の医療の種類と担当医の役割
研究段階の医療にはさまざまな制度が設けられています。参加できる試験や制度の調査、参加の手続きなどは、担当医を通して行われますので、研究段階の医療への参加を考える場合は、必ず担当医に相談してください。また、さまざまな制度があるため、担当医から専門の医療機関への照会や手続きなどに時間がかかる場合があります。
企業治験
新しい薬・医療機器などについて安全性および有効性を検証し、厚生労働省から承認を得ることを目的として行う治験のことです。製薬企業などから医師に依頼をして実施されます。
主たる治験
複数行われる治験のうち、安全性や有効性を確認する最終段階のものを指します。通常は、効能・効果および用法・用量が一連の開発を通じて設定された後に、安全性および有効性の検証を目的として行われます。
拡大治験
通常の治験の対象とならない患者に対して行う治験のことを指します。生命に重大な影響がある疾患で、既存の治療法に有効なものが存在せず、必要な薬の承認および保険適用を待つことができない場合に、人道的な観点から実施されることがあります。
医師主導治験
医療上の必要性に基づき、製薬企業などからの依頼ではなく医師自らが計画して行う治験のことです。製薬企業では開発が進まないような薬・医療機器などについて実施されています。
先進医療A
先進医療は、厚生労働大臣が定める高度な医療技術のうち、公的医療保険の対象にするかどうかを検討している段階のもの(評価療養)です。先進医療Aは、「未承認薬など(未承認あるいは承認内容の範囲外の薬や医療機器)を使用しない医療技術の中で、特に重点的な観察・評価を必要としないもの」、または「未承認薬などを使用する医療技術の中で、人体への影響が極めて少ないもの」が該当します。
先進医療B
先進医療Aと同じく、厚生労働大臣が定める高度な医療技術のうち、公的医療保険の対象にするかどうかを検討している段階のもの(評価療養)です。先進医療Bは、「未承認薬など(未承認あるいは承認内容の範囲外の薬や医療機器)を使用する医療技術の中で、人体への影響があると判断されるもの」、または「未承認薬などを使用しない医療技術の中で、特に臨床試験の中で安全性および有効性の評価が必要とされるもの」が該当します。
医師・研究者主導臨床試験
医師や研究者が計画し、主体となって行う臨床試験です。これまでに厚生労働省で承認された薬や治療法、診断法から、最良の方法や薬のよりよい組み合わせを確立することを目的として行われます。
患者申出療養
患者申出療養は、患者の「国が承認していない薬などを使った新しい治療を受けたい」という思いに応えるために設けられた、臨床試験を実施する制度です。治療の効果と安全性を確認しつつ、将来的に保険適用につなげるためのデータ、科学的根拠を集積することを目的としています。国内の未承認・適応外(承認内容の範囲外)のさまざまな治療法が対象になりますが、保険適用となることを目指すものに限られます。費用については、未承認薬などの費用に加え、研究支援者の人件費や研究の品質管理、統計解析のための費用などもかかり、患者負担が多額になる可能性があります。また、申請をしても必ず実施されるとは限りません。
参加できる条件や費用などは制度や試験によってさまざまです。まずは担当医にご相談ください。
詳細情報については医療関係者向けサイトに掲載されています。内容は複雑ですが、研究段階の医療について興味がある、検討したいときにご参照ください。
作成協力
