1.急性骨髄性白血病について
1)急性骨髄性白血病とは
血液の中にある赤血球、白血球、血小板などを血液細胞といいます。血液細胞は、骨の中心部にある骨髄で、血液細胞のもとになる造血幹細胞からつくられます(図1)。
急性骨髄性白血病は、骨髄芽球(白血球になる前の未熟な細胞)に異常が起こり、がん化した細胞(白血病細胞)が主に骨髄で無制限に増える病気です。
急性骨髄性白血病は、原因となる遺伝子が判明しているさまざまな種類があります。中でも、前骨髄球(骨髄芽球からさらに分化した細胞)に異常が起こるものがあります(図1)。これを「急性前骨髄球性白血病」といい、他の急性骨髄性白血病とは治療法が異なります。
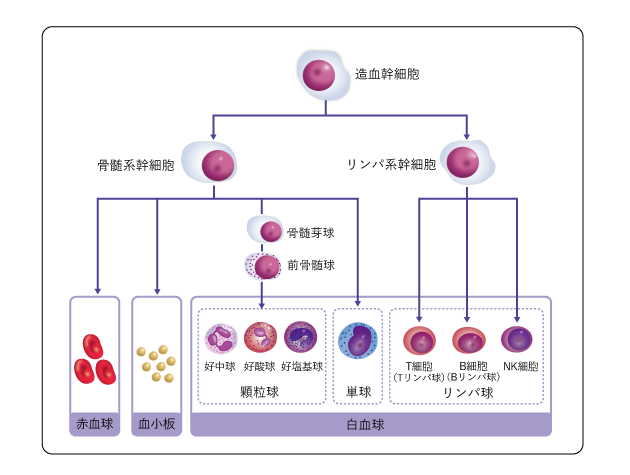
造血幹細胞から血液細胞ができるまで
造血幹細胞は、骨髄系幹細胞とリンパ系幹細胞に分かれて成長し、骨髄系幹細胞からは、赤血球、白血球(顆粒球、単球)、血小板などがつくられ、リンパ系幹細胞からは白血球の一種であるリンパ球(T細胞、B細胞、NK細胞)がつくられます。骨髄芽球は、骨髄系幹細胞の一部からつくられ、前骨髄球を経て顆粒球になります。
2)症状
白血病細胞が骨髄で増加することにより正常な血液細胞がつくられなくなり、赤血球、血小板、白血球が減少します。そのため、貧血の症状として息切れや動悸、血小板が少なくなるために鼻血や歯ぐきからの出血、発熱などの症状があらわれます。頭痛や関節痛などの症状があらわれることもあります。また正常な白血球が減少するために感染しやすい状態になることもあります。
急性骨髄性白血病は進行が速いため、多くの場合、急に症状があらわれます。速やかな診断と治療の開始が重要です。
2.検査
血液・リンパのがんでは、ほとんどの場合、診断や病型を確定するために骨髄検査(骨髄穿刺・骨髄生検)を受けます。骨髄検査は、皮膚を消毒し局所麻酔をした後に、一般的には腸骨(腰の骨)に針を刺して、骨髄組織を採る検査です。
なお、急性骨髄性白血病の場合は、診断や治療で使う薬の選択、治療の効果を判定するなどの目的で、染色体検査やがん遺伝子検査が行われます。
がんの疑いがあるときや治療中・治療後に受けることの多い検査についての情報は、「がんの検査について」をご参照ください。
3.治療
急性骨髄性白血病の場合は、年齢や体の状態などに応じて、複数の細胞障害性抗がん薬や分子標的薬を用いた薬物療法が行われます。造血幹細胞移植が行われることもあります。
急性前骨髄性白血病の場合は、全トランス型レチノイン酸(ビタミンの一種)と細胞障害性抗がん薬を用いた化学療法が行われます。再発した場合は、分子標的薬や細胞障害性抗がん薬などによる薬物療法の後に造血幹細胞移植が行われることもあります。
がんの診断から治療までの流れなどについては「8.関連する情報」、手術(外科治療)・薬物療法・放射線治療などの主な治療法に関する情報は「診断と治療」をご覧ください。「妊孕性(にんようせい)」には、妊娠や出産に関する情報を掲載しています。
1)患者向けの情報
治療の情報を含む患者向けのページを紹介しています。
2)医療従事者向けの情報
医療従事者向けの情報が掲載されています。
なお、上記は旧版のガイドラインです。改定版「造血器腫瘍診療ガイドライン2023年版」が2023年7月20日に発行されています。最新の情報は、改定版のガイドラインをご確認ください。
4.療養
「症状を知る/生活の工夫」には、がんの治療に伴う症状や自宅での生活の工夫などに関する情報を掲載しています。
特に、血液・リンパのがんは、がんそのものや薬物療法の影響で、健康な人には害のないような弱い細菌、真菌(カビ)やウイルスなどの病原体に感染しやすくなります。そのため、手洗いやうがいをしっかり行う、感染源を作らないためにけがをしないようにするなど、日常生活でも注意が必要です。
がんと診断されてからの仕事については「がんと仕事」、医療費や利用できる制度、相談窓口などのお金に関する情報は「がんとお金」をご参照ください。また、「がん相談支援センター」でも、仕事やお金、生活の工夫や利用できるサポート等、困ったときにはどんなことでも相談することができます。
「地域のがん情報」では、各都道府県等が発行しているがんに関する冊子やホームページへのリンクを掲載しています。併せてご活用ください。
5.臨床試験
国内で行われている急性骨髄性白血病の臨床試験が検索できます。
がんの臨床試験を探す チャットで検索
※入力ボックスに「急性骨髄性白血病」と入れて検索を始めてください。チャット形式で検索することができます。
がんの臨床試験を探す カテゴリで検索 白血病
※「カテゴリで検索」では、広い範囲で検索します。そのため、お探しのがんの種類以外の検索結果が表示されることがあります。
臨床試験への参加を検討する際は、以下の点にご留意ください
- 臨床試験への参加を検討したい場合には、担当医にご相談ください。
- がんの種類や状態によっては、臨床試験が見つからないこともあります。また、見つかったとしても、必ず参加できるとは限りません。
6.患者数(がん統計)
白血病は、日本全国で1年間に約14,000例(人)が診断されます。これは急性骨髄性白血病に加え、慢性骨髄性白血病、リンパ性白血病などを含む白血病全体の患者数です。急性骨髄性白血病は、1年間に診断される患者の数に関する正確なデータはありません。
7.相談先・病院を探す
情報や病院などが見つからないときにはご相談ください。
8.関連する情報
がんの治療を始めるにあたって、参考となる情報です。
9.参考資料
- 日本血液学会,造血器腫瘍診療ガイドライン2023年版.2023年,金原出版.
- 野村正満編.ハンドブック 白血病と言われたら 改訂第6版 下巻 血液の病気を知ろう.2020年,認定特定非営利活動法人全国骨髄バンク推進連絡協議会.
| 2023年12月06日 | 「造血器腫瘍診療ガイドライン2023年版」より、内容を確認して更新しました。 |
| 2022年08月23日 | 「5.臨床試験」の関連情報に、「患者本位の『がん情報サイト』」を追加しました。 |
| 2022年07月05日 | 「8.関連する情報」に「AYA世代の人へ」へのリンクを追加しました。 |
| 2022年06月23日 | 「3.治療」の関連情報に、「厚生労働科学研究班 がん対策研究紹介サイト 正しいがん情報の提供 研究成果・資料 1.白血病に関する資料」を追加しました。 |
| 2021年11月11日 | 「3.治療」の関連情報に「日本血液学会 造血器腫瘍診療ガイドライン 2018年版補訂版」の急性骨髄性白血病、急性前骨髄性白血病に関するページへのリンクと「日本小児血液・がん学会 小児白血病・リンパ腫の診療ガイドライン」へのリンクを追加しました。 |
| 2021年07月01日 | 構成を変更し、内容を更新しました。 |
| 2015年05月20日 | タブ形式に変更しました。「造血器腫瘍診療ガイドライン 2013年版」「造血器腫瘍取扱い規約2010年3月(第1版)」より内容を更新しました。 |
| 2006年10月01日 | 掲載しました。 |
