神経芽腫の治療法は、リスク分類に従って選択されます。
1.リスク分類と治療の選択
1)リスク分類
一般的には、国際神経芽腫リスク分類(INRGリスク分類、INRG:International Neuroblastoma Risk Group)が用いられます。この分類では、以下(1)~(6)の組み合わせにより、超低リスク、低リスク、中間リスク、高リスクの4つのリスクグループに分けられます(表1)。
(1)病期(腫瘍の進行の程度)
(2)診断時年齢(月齢)
(3)病理分類(組織分類)
(4)MYCN遺伝子の増幅
(5)染色体異常
(6)核DNA量(腫瘍細胞の染色体数)
| INRG 病期 |
診断時年齢 (月齢) |
INPC 組織分類 |
MYCN 増幅 |
染色体異常 (11q欠失) |
核DNA量 (染色体数) |
治療前 リスクグループ |
|
|---|---|---|---|---|---|---|---|
| 病期 L1/L2 |
- | 神経節腫 成熟型; 神経節芽腫 混在型 |
- | - | - | 超低リスク | |
| 病期L1 | - | 神経節腫 成熟型; 神経節芽腫 混在型を除くすべて |
なし | - | - | ||
| あり | - | - | 高リスク | ||||
| 病期L2 | 18カ月 未満 |
神経節腫 成熟型; 神経節芽腫 混在型を除くすべて |
なし | なし | - | 低リスク | |
| あり | - | 中間リスク | |||||
| 18カ月 以上 |
神経節芽腫 結節型 または 神経芽腫 |
分化型 | なし | なし | - | 低リスク | |
| あり | - | 中間リスク | |||||
| 低分化型 または 未分化型 |
- | なし | - | ||||
| - | あり | - | - | 高リスク | |||
| 病期M | 18カ月 未満 |
- | なし | - | 高2倍体 | 低リスク | |
| 2倍体 | 中間リスク | ||||||
| あり | - | - | 高リスク | ||||
| 18カ月 以上 |
- | - | - | - | |||
| 病期MS | 18カ月 未満 |
- | なし | なし | - | 超低リスク | |
| あり | - | 高リスク | |||||
| あり | - | - | |||||
(1)病期(腫瘍の進行の程度)
国際神経芽腫リスクグループ病期分類(INRG病期分類)によって、病期L1、病期L2、病期M、病期MSの4つに分類されます(表2)。原発腫瘍(原発巣)の広がり、画像診断から推定される手術(外科治療)のリスク(IDRF※)の有無、転移の有無から決められます。病期MSは1歳半未満の小児に限定された分類です。
※IDRF(image-defined risk factor)とは、局所のみの神経芽腫について、画像診断から手術のリスクを推定し、治療の最初に行う手術として摘出を行うか、生検のみで留めるのかを決める指標です。薬物療法(化学療法)後は、IDRFあり(陽性)の場合でも手術を行うことがあります。
| 病期L1 | 遠隔転移のない局所性腫瘍で、IDRFを有さない |
|---|---|
| 病期L2 | 遠隔転移のない局所性腫瘍で、IDRFを有する |
| 病期M | 遠隔転移を有する腫瘍(病期MSを除く) |
| 病期MS | 月齢18カ月未満で、皮膚、肝、骨髄にのみ転移を有する腫瘍 |
(2)診断時年齢(月齢)
一般的に、1歳半未満で発症した場合は比較的よく治りますが、1歳半以上で発症した場合は治りにくくなります。そのため、INRGリスク分類(表1)では18カ月未満と18カ月以上で分けられています。
(3)病理分類(組織分類)
病理分類(組織分類)は、治療前に採取した腫瘍組織を顕微鏡で観察して行います。国際神経芽腫病理分類(INPC)に従って、主に4つのグループに分けられます(表3)。
| 以下の4つのグループとそれぞれの亜分類に分ける(亜分類の記載は省略) |
|---|
1.神経芽腫(シュワンストローマ減少型)、ストローマ減少型 |
2.神経節芽腫、混在型(シュワンストローマ豊富型)、ストローマ豊富混在型 |
3.神経節腫(シュワンストローマ優位型) |
4.神経節芽腫、結節型(シュワンストローマ豊富型/ストローマ優位型およびストローマ減少型の複合) |
(4)MYCN遺伝子の増幅
腫瘍細胞がもつ特徴の中で、予後との関係が一番強い因子です。腫瘍組織の遺伝子検査の結果、MYCN遺伝子が増えている場合は腫瘍の悪性度が高いといわれています。
(5)染色体異常
腫瘍細胞の染色体の形を見ると、1番染色体短腕(1p)や11番染色体長腕(11q)が欠失している場合や、17番染色体長腕(17q)が増えている場合は治りにくいことが明らかになってきました(染色体検査)。
INRGリスク分類(表1)では、11番染色体長腕(11q)欠失を指標として採用しています。
(6)核DNA量(腫瘍細胞の染色体数)
人間の体細胞は、23本の染色体を2セットもつ2倍体です。神経芽腫の腫瘍細胞は、2倍体腫瘍と、染色体数がそれ以上存在する高2倍体腫瘍に分類されます。
進行期では2倍体腫瘍が多く見られ(染色体検査)、治りにくくなると考えられています。
2)治療の選択
図2は、神経芽腫に対する治療アルゴリズム(治療の手順)を示したものです。INRGリスク分類(表1)を用いて治りやすさに関する判定(予後因子判定)を行い、その後に、リスクグループに基づいて治療法が決められます。
担当医と治療方針について話し合うときの参考にしてください。
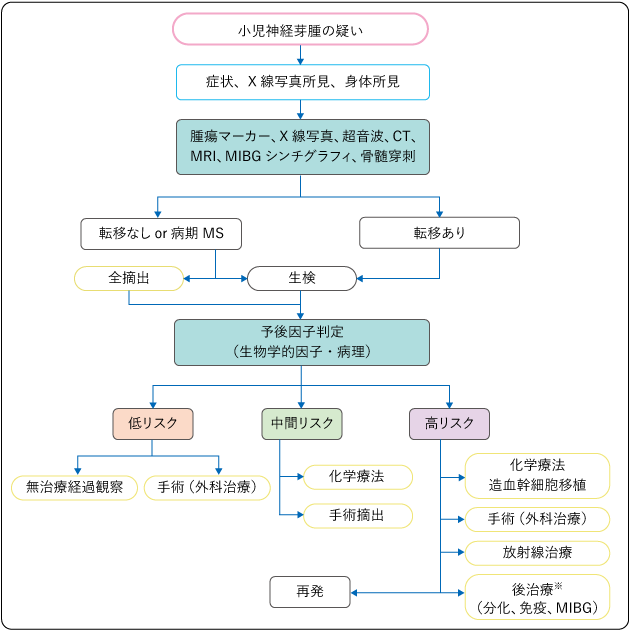
※分化誘導療法(がん細胞を普通の細胞に誘導させることにより治療する方法)、大量MIBG治療(123I-MIBGを放射性治療薬として用いる治療)は、わが国ではいずれも臨床試験などの研究段階の医療であり、保険の適用がされていません(2022年2月現在)。
低リスク群では、手術(外科治療)で腫瘍をすべて摘出できた場合は、治療を終了して経過観察を行います。手術で腫瘍をすべて摘出できない場合には、低用量の薬物療法の後に手術が行われる場合があります。また、1歳半未満で発症した一部の腫瘍では自然退縮する(腫瘍が自然に小さくなっていく)こともあるため、無治療経過観察が選択される場合もあります。
中間リスク群では、生検後に中等度の薬物療法を行ってから、原発腫瘍を摘出するための手術を行う治療法が一般的です。
高リスク群では、腫瘍が周囲の臓器や血管を巻き込んでいることや、転移がある場合が多くあります。治療としては、薬物療法を先行し、周囲の臓器をできるだけ温存した手術と局所の放射線治療、大量化学療法(抗がん剤の投与量を増量して行う治療)と自家造血幹細胞移植を行います。多施設での臨床試験として治療が行われることが多く、経験のある医療機関で治療を行う必要があります。
2.手術(外科治療)
1)手術の概要
手術はその目的から、大きく2つに分けられます。1つは、神経芽腫の確定診断とその悪性度判定のために、腫瘍の一部を切除して調べる手術(生検)で、もう1つは腫瘍(手術部分)を目で見ながら切除する手術(腫瘍摘出術)になります。
神経芽腫では手術で腫瘍すべてを摘出しなくてもよい場合があり、リスクや病状に応じて適切な手術方針が立てられます。集学的治療(薬物療法、手術、放射線治療などのさまざまな治療法を組み合わせた治療)に精通している医療機関で、神経芽腫の治療経験が豊富な外科チームによる治療を受けることが推奨されます。
(1)開腹または開胸による腫瘍摘出術
腹壁や胸壁を大きく切開して広げ、手術部分を目で見ながら腫瘍を摘出する手術で、腫瘍を切除するときに最も多く用いられる方法です。特に薬物療法後の2回目の手術で腫瘍周囲のリンパ節などを一緒に切除するときには、必ず用いられます。
また、側腹部あるいは背部から腹壁を切開する後腹膜経路の腫瘍摘出術もあります。副腎に発生した早期の神経芽腫で、周囲臓器や血管などの巻き込みがなく、比較的容易に腫瘍が摘出できると考えられる場合などに用いられることがあります。
(2)内視鏡(腹腔鏡または胸腔鏡)による腫瘍摘出術
内視鏡処置用の手術器具を挿入するために、1cm程度の穴(孔)を3~4カ所空けて、その小さな穴を通して行う手術です。腫瘍の部位や大きさ、血管への浸潤の有無によって、実施が検討されることがあります。
2)1歳半未満の小児に対する手術(外科治療)
健診などで偶然に神経芽腫が見つかった子どもは、転移のない早期である場合が多く、大部分は腫瘍自体の悪性度も高くありません。そのような場合の治療の主体は、手術で腫瘍を切除することになります。
摘出した腫瘍自体の悪性度が高くなければ、手術後に薬物療法や放射線治療を追加する必要はありません。しかし、脊髄圧迫症状や呼吸障害などの強い症状がある場合には薬物療法を行います。
また、症状が無い一部の腫瘍に対しては、手術や薬物療法も行わず、自然退縮(腫瘍が自然に小さくなっていくこと)を期待して経過観察のみ(無治療経過観察)を行う場合もあります。担当医からの十分な説明とご家族の理解のもと、その後の注意深い観察が必要となります。無治療経過観察の場合を除いては生検を行い、腫瘍の悪性度を判定することが必要です。
3)術後合併症
開腹手術の場合、術後に癒着性腸閉塞の合併症を起こすことがあります。
また、頸部や胸部の交感神経節から発生した神経芽腫では、手術をした側の縮瞳(瞳孔が縮小した状態)、眼瞼(まぶた)の垂れ下がり、顔面の発汗の減少を主な特徴とするホルネル症候群が見られることがあります。腫瘍摘出時に交感神経幹を切断しなければならないため、ホルネル症候群は避けられない合併症です。
さらに、副腎や腎臓近くの後腹膜から発生した腫瘍を摘出した場合、手術操作による損傷や刺激により腎動脈(腎臓に血液を送る動脈)に狭窄が起こり、血流低下を招くことで腎臓の萎縮を合併することがあります。
3.放射線治療
高リスク群に対しては、手術後に微細に残っている腫瘍をなくすため、および骨転移部位への局所療法として、放射線治療を行います。
放射線を照射する範囲や放射線の量は、それまでの治療に対する反応や、手術の結果などを基に決められます。多くの場合、治療期間は2~3週間程度になります。一般的にはX線による治療が行われていますが、陽子線という放射線を用いることもあります。また、病気が再発したときに、対症的に痛みを取るなどの治療として、放射線治療を行うこともあります。
4.薬物療法
INRGリスク分類(表1)によって分けられた低リスク群(超低リスクを含む)、中間リスク群、高リスク群ごとに、次のような薬物療法が行われます。
1)低リスク群(超低リスクを含む)
低リスク群でも、手術で腫瘍をすべて摘出できない場合は低用量の薬物療法が行われます。手術で腫瘍をすべて摘出できない子どもや、脊髄圧迫症状や呼吸障害などの強い症状がある子どもについては、ビンクリスチン、シクロホスファミドなどを用いた低用量の薬物療法を短期間行い、腫瘍を小さくしてから手術により摘出を試みる場合があります。
2)中間リスク群
中間リスク群に対する標準治療は確立していませんが、生検後に中等度の薬物療法を実施し、腫瘍を縮小させてから、原発腫瘍の摘出術を行う治療法が一般的に行われています。
3)高リスク群
薬物療法、手術、放射線治療などのさまざまな治療法を組み合わせた集学的治療を行います。高リスク群では、寛解導入療法(大量化学療法を行うまでの薬物療法)として、一般的にシスプラチン、エトポシド、ドキソルビシン、シクロホスファミド、ビンクリスチンなどからなる多剤併用療法が行われます。その後、自家造血幹細胞移植(あらかじめ保存しておいた自分の造血幹細胞を移植する方法)を併用した大量化学療法が検討されます。腫瘍摘出術は、大量化学療法の前ないし後で行います。また、放射線治療は、一般的に大量化学療法後に行います。
免疫療法である抗GD2抗体が2021年から実施可能となりました。欧米では大量化学療法後の後治療として、免疫療法(抗GD2抗体)に加えて、分化誘導療法や、併用療法としての大量MIBG治療などが行われていますが、国内ではいずれも研究段階であり、保険の適用がされていません(2022年2月現在)。
5.緩和ケア/支持療法
がんになると、体や治療のことだけではなく、学校のことや、将来への不安などのつらさも経験するといわれています。
緩和ケアは、がんに伴う心と体、社会的なつらさを和らげます。がんと診断されたときから始まり、がんの治療とともに、つらさを感じるときにはいつでも受けることができます。
支持療法とは、がんそのものによる症状やがんの治療に伴う副作用・合併症・後遺症を軽くするための予防、治療およびケアのことを指します。
本人にしか分からないつらさもありますが、幼い子どもの場合、自分で症状を表現することが難しいこともあります。そのため、周りの人が本人の様子をよく観察したり、声に耳を傾けたりすることが大切です。気になることがあれば積極的に医療者へ伝えましょう。
6.再発した場合の治療
再発とは、治療の効果により腫瘍がなくなった後、再び腫瘍があらわれることをいいます。
原発部位の再発だけでなく、骨などの転移巣として再発することがあります。再発した場合に推奨される特定の治療法は定まっていませんが、骨に転移した場合は放射線治療を行う場合があります。また、臨床試験や治験に基づく試験的治療を行うこともあります。
再発は、子どもによって状態が異なりますので、症状や体調あるいは本人や家族の希望に応じて治療やケアの方針を決めていきます。
診断時に低リスク群または中間リスク群であった場合は、再発の状況によって治療法はさまざまですが、それぞれの状況に見合った治療を行うことにより、ある程度良好な予後が期待されます。
一方、診断時に高リスク群であった場合の再発では、確立された救援療法はありませんが、薬物療法など個別の状況に応じた治療法が検討されます。
